近年来,我国将基因检测作为国家重点领域,加大了支持力度,先后推出了多项政策、制度进行扶持,为行业的发展创造了良好的政策环境。
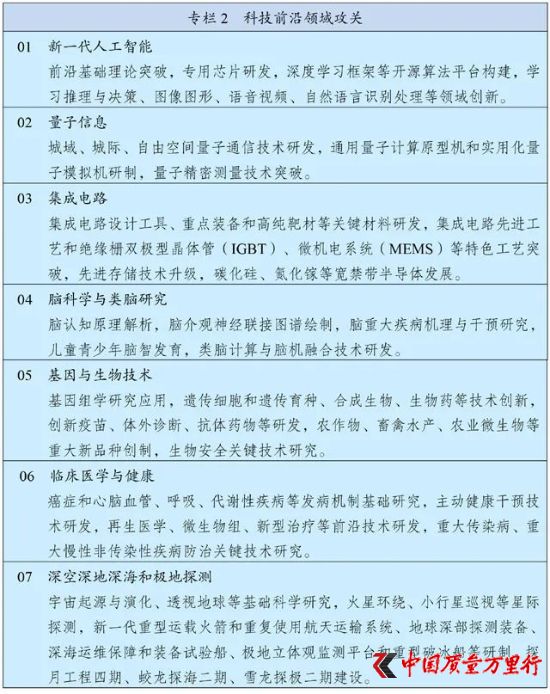
“十四五”规划中提到的“基因与生物技术”
今年3月12日,《中华人民共和国国民经济和社会发展第十四个五年规划和2035年远景目标纲要》正式发布,明确“基因与生物技术”作为七大科技前沿领域攻关领域之一;“生物技术”作为九大战略性新兴产业之一,其中“基因技术”为未来产业。
由于基因检测涉及伦理、隐私和人类遗传资源保护、生物安全等问题,早在2014年2月9日,原国家卫计委办公厅以及原国家食药局办公厅联合发布《关于加强临床使用基因测序相关产品和技术管理的通知》,全面叫停基因检测。该通知规定,在相关的准入标准、管理规范出台以前,任何医疗机构不得开展基因测序临床应用,已经开展的,要立即停止。
基因检测叫停一个月后,2014年3月,原国家卫计委发布《关于开展高通量基因检测技术临床应用试点单位申报工作的通知》。通知要求已经开展高通量基因测序技术,且符合申报规定条件的医疗机构可以申请试点,并按照属地管理原则向所在省级卫生计生行政部门提交申报材料,同时明确申请试点的基因测序项目,如产前筛查和产前诊断、遗传病诊断、肿瘤诊断与治疗、植入前胚胎遗传学诊断等。
2015年,随着政策方面逐渐转暖,我国先后批准了一些大型的三甲医院和有资质的第三方检测中心,作为高通量基因测序在遗传病、无创产前诊断及肿瘤诊断方面应用的试点单位。
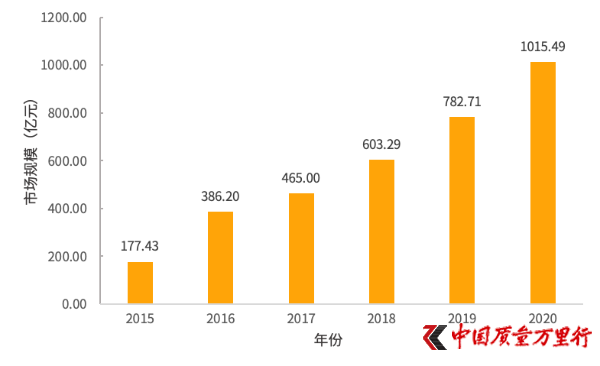
2015—2020年我国基因检测行业市场规模(图片来自:火石创告)
从2016年基因检测正式写入“十三五”规划,到2020年《生物安全法》的出台,五年间,我国基因检测得到了有效监管与全面发展。
2016年,我国过先后发布了多条与之相关的关键性国家政策,基因检测经历了从产业发展倒逼政策改革,到以政策引导产业发展的阶段。
3月,科技部下发了《国家重点研发计划2016年度项目申报指南》的通知,其中“精准医学研究”被列入优先启动的重点专项,并正式进入实施阶段。
4月15日,国家发改委下发了《国家发展改革委办公厅关于第一批基因检测技术应用示范中心建设方案的复函》(发改办高技[2016]534号),正式批复建设全国27个基因检测技术应用示范中心,鼓励加快基因检测产业的快速发展。
4月23日,中国临床肿瘤医学会发布的中国首部《肿瘤驱动基因分析联盟(CAGA)二代测序技术临床应用共识》,帮助指导基因检测技术规范合理应用,给我国患者带来更切实的治疗。
7月,原国家卫计委公布了第一批二代基因测序技术临床应用示范单位及遗传病诊断等试点专业。
8月,国务院正式印发了《“十三五”国家科技创新规划》,共提及“医药”一词近20次,涉及了精准医疗、基因编辑、免疫治疗、干细胞等多个热门领域。
10月,原国家卫计委发布了《医学检验实验室基本标准(实行)》的管理文件,其中规定:开展产前筛查与产前诊断项目的实验技术人员应具备产前筛查与诊断的相应资质。
11月7日,工信部、国家发改委、科学技术部、商务部、原国家卫生和计划生育委员会与原国家食品药品监督管理总局6部门联合发布《医药工业发展规划指南》,基因检测正式写入“十三五”规划。
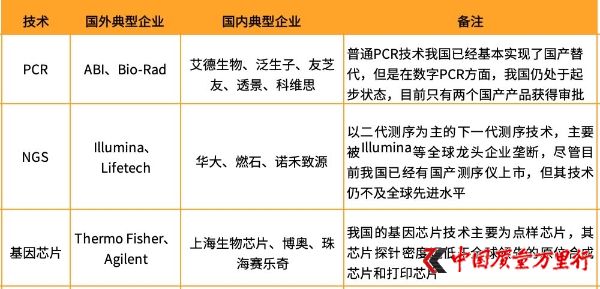
基因检测技术典型企业(图片来自:火石创告)
2017年,我国启动十万人基因组计划,十三五规划将发展基因技术作为生物医药产业创新的核心任务,在此背景下,以基因技术为核心的生物产业将获得快速发展,带动基因测序行业迈入爆发期。
1月,国家发展改革委发布《“十三五”生物产业发展规划》规划,基因检测、细胞治疗、免疫治疗、基因编辑、产前筛查等多个热门概念被“点名”,并且提出实现基因检测能力(含孕前、产前、新生儿)覆盖出生人口 50% 以上。
2月,基因科技正式写入发改委1号文:《战略性新兴产业重点产品和服务指导目录》。
6月,国家六个部委联合发文:《“十三五”卫生与健康科技创新专项规划》,规划纲要明确要求加强基因治疗、细胞治疗等关键技术研究,加快生物治疗前沿技术的临床应用,创新治疗技术,提高临床救治水平。
12月,原国家卫计委重磅发布两项个体化医学指南《感染性疾病相关个体化医学分子检测技术指南》和《个体化医学检测微阵列基因芯片技术规范》。
12月28日,我国启动“中国十万人基因组计划”,这是我国在人类基因组研究领域实施的首个重大国家计划,也是目前世界最大规模的人类基因组计划。分别涉及基因组计划、高通量测序仪和新型分子诊断技术,其中新型分子诊断技术明确指出重点发展液体活检、肿瘤和传染病基因检测等。
2018年,我国加大扶持精准医疗的浪潮仍在持续,“十三五”规划等一系列利好政策的相继出台推动了基因测序行业的进一步发展;同时,日益完善的监管体系使得市场秩序更加有序,行业竞争日益规范。
1月,工信部发布《首台(套)重大技术装备推广应用指导目录》,共有32种医疗设备产品可以享受到“首台套”推广应用政策的扶持,医疗设备产品中包括高通量基因测序仪。
11月,科技部发布《已批准的人类遗传资源行政许可项目信息汇总(2018第二十二批)》。对我国人类遗传资源采集、收集、出口出境行为的审批流程做进一步规范和完善。
11月,国家卫健委发布《医疗技术临床应用管理方法》正式实施,对禁止临床应用的医疗技术实施负面清单管理,对部分需要严格监管的医疗技术进行重点管理。
12月,国家卫健委发布《关于印发全国出生缺陷综合防治方案的通知》。明确规范广泛开展产前筛查,逐步扩大筛查病种,规范应用高通量基因测序等新技术,促进早发现早治疗,减少先天残疾。
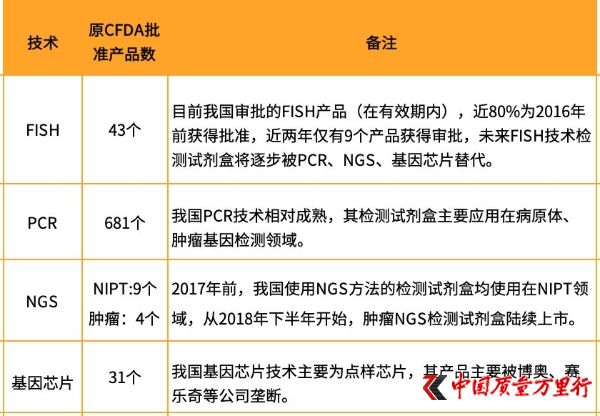
我国基因检测试剂盒产品情况(图片来自:火石创告)
2019年,《健康中国行动(2019—2030年)》明确提出“加快推动从以治病为中心”转变为“以人民健康为中心”,彰显预防是最经济、最有效的健康策略,基因检测也随着“健康中国2030”上升为国家战略之后成为健康产业的新风口。
4月,国家药监局启动了中国药品监管科学行动计划,药审中心负责实施的“细胞和基因治疗产品技术评价与监管体系研究”纳入首批研究项目。
5月,由国家卫健委能力建设和继续教育中心主办的遗传咨询能力建设专家委员会在北京成立,旨在推动建立权威、科学、规范的遗传咨询师国家职业标准,弥补遗传咨询在国内的空白。
7月,国务院公布《关于实施健康中国行动的意见》,明确提出“加快推动从以治病为中心”转变为“以人民健康为中心”,彰显预防是最经济、最有效的健康策略。
8月,中国首个PD-L1检测试剂盒获批上市,医学进入精准医学时代,精准的诊断尤为重要。
2020年,《2021基因行业蓝皮书》中指出,应用发展的政策窗口期在2019-2020年打开,但恰逢人类遗传资源管理、基因编辑及生物安全相关法规出台,需要一定周期的规范化和市场教育。
3月,《微生物组测序与分析专家共识》发表于2020年生物工程学报。涵盖从微生物采集与保存、DNA 提取与建库、高通量基因测序和数据分析以及质控标准品等全流程。
3月,《临床遗传病基因检测全流程规范化共识探讨》发表于中华医学遗传学杂志。这是国内首个由“第三方基因检测机构代表+临床及科研专家”共同商讨、基于基因科技发展和实际应用场景达成的行业共识。
7 月,第十三届全国人大常委会第二十次会议对《中华人民共和国刑法修正案(十一)(草案)》进行了审议,首次将非法基因编辑、非法采集和使用国家人类遗传资源等纳入刑法规制范围。
9月,国家药品监督管理局药品审评中心(CDE)发布《基因治疗产品药学研究与评价技术指导原则(征求意见稿)》。同月,国家药品监督管理局也正式发布全球首个高通量基因测序仪标准,规范了上游数据生产的基本标准。
10月出台的《生物安全法》,将人类遗传资源有关活动的安全管理纳入监管。
12月,国家卫健委连续印发《抗肿瘤药物临床应用管理办法(试行)》及《新型抗肿瘤药物临床应用指导原则(2020 年版)》等文件,明确指出由国家卫生健康委发布的诊疗规范、临床诊疗指南、临床路径或药品说明书中规定需进行基因靶点检测的靶向药物,使用前需经靶点基因检测,确认患者适用后方可开具。









 京公网安备11010502034432号
京公网安备11010502034432号